صيغة كيميائية، دبق غراء، الصيغة
صيغة الجير المطفأ

هذه المواد، مثل الجير المكسور، معروفة للبشرية منذ العصور القديمة. نظرا لخصائصه المفيدة، تطبيقه لم تفقد أهميتها لهذا اليوم. وقد لمست الفرق فقط التوسع في مجال الاستخدام.
من أجل فهم كيف حدث هذا، فمن الضروري معرفة، ما الجير المكسور له صيغة، وكيف يؤثر هذا على تفاعله مع المواد الأخرى.
بعيدا عن دائما في الحياة الحقيقية، وإنتاج الجير المطفأ يحدث في الظروف التي لا توجد فيها مواد إضافية. في كثير من الأحيان، المغنيسيوم، رمل الكوارتز، وما إلى ذلك تضاف إلى رد الفعل. وهذا ضروري لتعزيز خصائص معينة من المواد، والتي سوف تنتج عن التفاعل بين جميع المكونات.
وبالنظر إلى الانتشار الواسع النطاق للجير المائي في مناطق مختلفة من العالم، وكذلك في مختلف مجالات النشاط، تم استدعاؤه بطرق مختلفة. ومن بين الأسماء الأكثر شيوعا والشائعة ما يلي:
ويعكس هذا المصطلح صيغة المادة، لأنها تتكون من الكالسيوم وهيدروكسيد. يتم استخدامه في الأدب العلمي والتقني.
واليوم، حل هذا المصطلح محل الأسماء الأخرى في العديد من المجالات.

- الجير سلاكد. هنا حول تطبيقه. كان هناك مثل هذا الاسم بسبب حقيقة أن يتم الجوهر عن طريق الخلاص (أي إضافة الماء).

هذا هو الجير، والذي يحدث بسبب الكثير من الجير المائي في نسبته مع المحاليل المائية ومباشرة مع الماء.
يبدو قليلا مثل الحليب في لونه.

- الجير. يشار إلى هذا المصطلح ب وهو حل شفاف يتم الحصول عليه بعد الترشيح.

- الجير أو الجير المقطوع.
يتم الحصول على هذه المواد في الحالات التي لا تستخدم فيها مادة طويلة.
خلال هذه الفترة، فإنه يبدأ في امتصاص ثاني أكسيد الكربون من البيئة، وبالتالي ترسيخ.

وهناك أيضا عدد من الأسماء والمصطلحات الأخرى التي تستخدم للإشارة إلى الجير المطفأ. واستخدمت جميعها بطريقة أو بأخرى لفترة معينة، أو كانت تستخدم حاليا.
تكوين الجير سلاكد بسيط جدا ومباشرة. هذه المادة يتكون من أكاسيد الكالسيوم فقط، متصلة في تسلسل معين. ويعتبر إنتاج هيدروكسيد الكالسيوم أيضا الابتدائية. كان قادرا على إنتاج لعدة آلاف من السنين.
للقيام بذلك، تحتاج فقط إلى إضافة الماء إلى أكسيد الكالسيوم، وبعد ذلك يجب أن تكون مختلطة هذه المكونات بشكل جيد ودقيق مع بعضها البعض.
تتم كتابة الصيغة الكيميائية للجير المائي ك كا (أوه) 2. عملية الحصول على هيدروكسيد الكالسيوم هي كما يلي: تساو + H2O = كا (أوه) 2.

عندما صب أكسيد الكالسيوم مع الجير الماء يتم الحصول عليها، والتي تعتمد بشكل مباشر على الوقت من التعرض لكل المكونات الأولية غيرها من الخصائص.
إذا استمر الخلط لمدة تصل إلى 8 دقائق، ثم يمكننا أن نتحدث عن الجير التبريد السريع، حوالي 25 دقيقة – منتصف التبريد، وأكثر من نصف ساعة – يموت منذ فترة طويلة. صيغة الكلس المائي كا (أوه) 2 هي وهو مركب يحتوي محلول مائي على قلوي.
وقد عرفت صيغة الجير المائي في الكيمياء لفترة طويلة. وحتى الآن، حتى دراستها في الدورة المدرسية لهذا الموضوع. في كثير من الأحيان، في الدروس في وجود المعلم، والأطفال إطفاء أكاسيد الكالسيوم، يلاحظ رد فعل عنيف مع الافراج عن الحرارة.
ولكن إنتاج هيدروكسيد الكالسيوم على نطاق صناعي هو عملية مختلفة قليلا، تتطلب قواعد ومعايير معينة.
وينظم في رف من قبل الوثائق التنظيمية الخاصة تسمى غوست 9179-77. فمن له أن يسترشد بها كل منتجي هذه المادة.
ومن بين المتطلبات الإلزامية للتنفيذ، تجدر الإشارة إلى ما يلي:
- يجب على الشركة المصنعة استخدام صخور كربونات فقط مع إمكانية استخدام كمية صغيرة من المضافات المعدنية. كل درجة من الجير لديها حجمها الخاص من المواد الإضافية، والتي يمكن إدخالها في ذلك. يتم تحديدها من قبل غوستس ولا يمكن أن تنتهك.
- يرصد كيكليم في شكل ثلاثة أصناف. لا ينبغي أن يكون هناك أي إضافات في ذلك. يمكن إنتاج الجير المسحوق مع إضافة إضافية في درجتين مختلفتين؛

- وتنقسم المواد الموزعة أيضا إلى نوعين – مع وبدون إضافات.

- يجب أن تستند الجير الكالسيوم في المقام الأول على الكالسيوم. كمية أكسيد المغنيسيوم (مغو) في ذلك يجب أن لا تتجاوز 5 في المئة.
- وفقا ل غوستس، يمكن أن يكون الجير دولوميتيز أكسيد المغنيسيوم (مغو) في تكوينها تصل إلى 20 في المئة.
- الجير دولوميتيك هو المادة التي أكسيد المغنيسيوم (مغو) تحتل ما يصل الى 40 في المئة من الحجم الكلي.

- فإن الجير الهيدروليكي ينطوي على إدراج مواد مثل السيليكا وأكاسيد الحديد، وكذلك الطين في مكوناته.
خصائص الجير تعتمد أساسا على اثنين من العوامل الرئيسية، وهي عملية صنع الخبز الصخور. العلاج الحراري يسمح خلق في الفرن شظايا قوية من مادة سريعة.
أكثر بيضاء اتضح، وأكثر جودة يمكن للمرء أن تنظر هذا المنتج. في المقابل، بعض أنواع الجير هي أكثر رمادية.
عندما يكون هناك اتصال من الجير مع الماء، يتم تحرير الغاز منه، والذي هو في الداخل. بعد ذلك، التغييرات المادية إلى حالة السوائل.
تركيزه يعتمد بشكل مباشر على كمية المياه المستخدمة. قوة المادة يمكن أن تتحول مختلفة، والتي تتأثر السمات التكنولوجية للتصنيع. يمكن أن يكون من الصعب حرق المواد، نسخة متوسطة وحرق المواد بهدوء.
وبوجه عام، فإن عملية الشراء الكاملة للجير تتكون فقط في مرحلتين من الإنتاج:
- التعدين مباشرة الأحجار الكريمة جدا والمضافات التي يتم استخدامها. بالنسبة للنوع المقطوع، غالبا ما تستخدم منتجات النفايات؛
- وإطلاق الأنواع المحصودة في أجهزة الفرن المصممة خصيصا في ظل ظروف درجات الحرارة المرتفعة.
يتم استخراج الحجر الجيري في المحاجر. وفيما يلي خصائص الرمال المحجر. للقيام بذلك، استخدم الأسلوب المفتوح. يتم تقسيم سلالة مع المتفجرات. إذا كنا رسم انتاج الجمركية، ونحن الحصول على المواد الخام وموحدة في تركيبتها الكيميائية، الأمر الذي يجعل من أفضل المواد لاحقا الجودة.

العملية التحضيرية للمواد الخام التي تم الحصول عليها في المحجر يعني سحقها إلى قطع صغيرة. وفي هذه الحالة، يجب أن تكون متجانسة. ويرجع ذلك إلى ارتفاع درجة الحرارة في الفرن، والتي هي قادرة على جزيئات صغيرة جدا لتدمير لكنها كبيرة جدا وهذا – لا يحرق تماما حجم كله.
إطلاق النار هو المرحلة الرئيسية في إنتاج الجير الهواء. نظام درجة الحرارة يجب أن تتوافق مباشرة مع تلك الشوائب التي هي في الصخور.
ويجب أن تستوفي العملية نفسها جميع متطلبات التكنولوجيا، لأن أي انتهاك يمكن أن يؤدي إلى نتيجة تؤدي إلى رداءة نوعية المادة. على سبيل المثال، الجير المحترق جدا غير قابل للذوبان في الماء.
وبالإضافة إلى ذلك، لديها كثافة أعلى نسبيا، مما يؤثر سلبا على إعداد الحلول. هنا عن كثافة رمل النهر. وتستخدم أفران مختلفة لعملية اطلاق النار. في الآونة الأخيرة، وقد استخدمت التعدين والتناوب المنتجات أنبوبي.

الأول يختلف في أنها تعمل بشكل مستمر، مما يجعلها أكثر اقتصادا وفعالية من حيث التكلفة. هذا الأخير يسمح تحقيق أعلى مستويات الجودة، لأن لهم تأثير درجة الحرارة على الصخور يحدث بالتساوي وبشكل صحيح من وجهة نظر التكنولوجيا.
وبالإضافة إلى ذلك، وضعت الشركات المصنعة الأجهزة التي تسمح الصخور أن تكون مخبوزة في سرير مميعة أو في حالة معلقة.
وهي تستخدم أساسا فيما يتعلق أصغر جسيمات من المواد. عيب هذا الإنتاج هو الربحية منخفضة إلى حد ما.
وقد وجد الجير المطفأ بسبب خصائصه نطاقا واسعا جدا. يتم استخدامه، سواء لأغراض شخصية، من قبل كثير من الناس، والصناعة، سواء في بناء أنواع مختلفة من الكائنات، والتطهير. وتجدر الإشارة إلى الطرق المحددة التالية لاستخدام هذه المادة:
- لتبييض الأشجار – الجير يسمح لحمايتهم من نوع من الآفات.

- في تبييض المباني الداخلية مرافق للتطهير؛

- لطلاء المنتجات الخشبية, إطالة عمر الخدمة، وبالتالي حماية من عمليات التعفن والإشعال؛

لوحة من الأسطح الخشبية
- لصنع التبييض, تستخدم أساسا للتطهير؛

- كما الموثق في مختلف قذائف الهاون. هنا نسب هاون الاسمنت والجير للتجصيص.

- في صناعة الخرسانة السيليكاتية.هنا حول استهلاك الأسمنت لكل 1 مكعب من الخرسانة.

- لصنع الأسمدة في الأرض، وزيادة إنتاجية المحاصيل؛

- للدباغة الجلود، باعتبارها واحدة من مكونات العملية التكنولوجية؛
- لتحييد زيادة الحموضة في حالات التطبيق في المركبات مع الكالسيوم؛
- لتصنيع المضافات الغذائية، وخاصة E526؛
- للكشف عن وجود ثاني أكسيد الكربون.
- في صناعة السكر, باستخدام حليب الجير؛
- إذا لزم الأمر تطهير الأسنان في عيادات الأسنان.
بالإضافة إلى المناطق المذكورة أعلاه، ويستخدم الجير الصودا لأغراض أخرى كثيرة. هنا هو صيغة الجير الصودا. أولا وقبل كل شيء، كان يتأثر خصائصه مفيدة جدا والخصائص التقنية.
وبالإضافة إلى ذلك، وإنتاج مثل هذه المواد من السهل جدا وليس غير مريح.
لمزيد من المعلومات حول استخدام الجير، انظر الفيديو:
الحفاظ على حالة عمل المادة
تكلفة الجير لهذا اليوم ليست عالية جدا، ويرجع ذلك إلى التصنيع في كل مكان وبساطة من عملية الإنتاج التكنولوجي. ولكن، على الرغم من هذا، بعد أن اشترى هذه المواد، فمن الضروري أن نفهم كيفية تمديد حالة العمل.
وتوجد توصيات الخبراء التالية:
- إذا كانت كثافة المواد تتغير بسبب حقيقة أن تبخر الرطوبة منه, فإنه يمكن فقط إضافة القليل من الماء؛
- في عملية استخدام الجير سلاكد، يجب أن يحرك في كل وقت.
- إضافة الماء متروك لتلك الدولة، حتى المواد توقف امتصاصه.
- لتخزين الجير، فمن الضروري لأعلى عنه مع طبقة من الرمل، ضيف 8736، 20 سم عالية؛
- إذا تم تخزين كمية كبيرة من المواد في فصل الشتاء على أرض مفتوحة، فمن الضروري لحمايته من الصقيع. للقيام بذلك، يجب تغطية الجزء العلوي مع الرمل، وعلى رأسها لإضافة طبقة من التربة. هنا الحرارة محددة من الرمال؛
- استخدام المواد التي هناك نشارة الخشب، وإدراج أو كتل، لا يستحق كل هذا العناء. وهذا يمكن أن يؤثر بشكل كبير على سلامة السطح الذي يجري معالجته.
- إذا تم استخدام الجير لإعداد الحل، ثم يجب أن يكون التعرض لمدة أسبوعين على الأقل. للجص يعمل عليه ينبغي أن تمتد إلى 4 أسابيع.
إذا تم استيفاء جميع المتطلبات المذكورة أعلاه، سيتم استخدام الجير المطفأ جيدا إلى حد ما لأغراض مختلفة دون أي مشاكل. إذا نشأت، فإن هذا يمكن أن يشير إلى سوء نوعية المواد، وليس عن ظروف التخزين والاستخدام.
ومن المعروف أن صيغة رطب وسريع لفترة طويلة من الزمن، في حين أن استخدام هذه المواد لديها تاريخ طويل. خلال هذه الفترة فإنها لم تفقد على الإطلاق أهميتها وفائدتها، سواء بالنسبة للإنسان أو للمجتمع ككل.
ويساهم الإنتاج الصناعي لهذه المواد في التنمية الصناعية وتحسين العديد من التكنولوجيات. وهذا هو السبب في أنه من المهم جدا أن تتم عملية الإنتاج بشكل واضح وفقا ل غوستس ووفقا لقواعد معينة. في هذه الحالة، فإن استخدام الجير تكون مفيدة ومفيدة.
صيغة الجير المطفأ
تعريف وصيغة الجير المطفأ
سيئة للذوبان في الماء (يتم تشكيل حل قلوي المخفف). فإنه يدل على الخصائص الرئيسية، يتفاعل مع الأحماض. تمتص ثاني أكسيد الكربون من الهواء.

التين. 1. الجير المطفأ. المظهر.
ويسمى حل الجير المائي في الماء الماء الجير.
الصيغة الكيميائية للجير المطفأ
الصيغة الكيميائية للجير المطفأ كا (أوه)2. وتبين أن هذا الجزيء يحتوي على ذرة واحدة من الكالسيوم (أر = 40 أمو)، ذرات هيدروجين (أر = 1 أمو) واثنين من ذرات الأوكسجين (أر = 16 أو). م.). وفقا للصيغة الكيميائية، فمن الممكن لحساب الكتلة الجزيئية من الجير المطفأ:
صيغة بيانية (هيكلية) من الجير المطفأ
الصيغة الهيكلية (الرسومية) من الجير المائي أكثر وضوحا. ويظهر كيف ترتبط الذرات ببعضها البعض داخل الجزيء (الشكل 2).
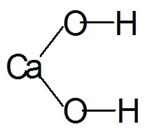
التين. 2. صيغة رسومية من الجير المطفأ.
الجير المطفأ هو قاعدة حمضين قادرة على التفكك في الأيونات في محلول مائي وفقا للمعادلة التالية:
ونحن نشير إلى عدد من الشامات من العناصر التي تشكل مجمع ل “x9raquo. (البوتاسيوم)، “у9raquo؛ (الكبريت) و “z9raquo؛ (الأكسجين). ثم، فإن النسبة المولي تبدو كما يلي (يتم تقريب قيم الكتل الذرية النسبية المأخوذة من الجدول الدوري ل دي منديليف إلى الأعداد الصحيحة):
x: y: z = 49.4 / 39: 20.2 / 32: 30.4 / 16؛
x: y: z = 1.3: 0.63: 1.9 = 2: 1: 3
وبالتالي فإن أبسط صيغة للجمع بين البوتاسيوم والكبريت والأكسجين سيكون K2SO3 وكتلة مولية من 158 غرام / مول [M (K2SO3) = 2 × أر (K) + أر (S) + 3 × أر (O) = 2 × 39 + 32 + 3 × 16 = 78 + 32 + 48 = 158 جم / مول].
دعونا نجد الكتلة المولية الحقيقية لهذا المركب:
Mمادة = أر (كا) × 3.95 = 40 × 3.95 = 158 جم / مول
للعثور على الصيغة الحقيقية للمركب العضوي، نجد نسبة الكتلة المولية التي تم الحصول عليها:
وبالتالي فإن صيغة الجمع بين البوتاسيوم والكبريت والأكسجين له شكل K2SO3.
دعونا نجد الكتلة المولية من الكالسيوم والنيتروجين والأكسجين (يتم تقريب قيم الكتلة الذرية النسبية المأخوذة من الجدول الدوري ل دي منديليف إلى الأعداد الصحيحة). ومن المعروف أن M = السيد، وبالتالي M (كا) = 40 غرام / مول، أر (N) = 14 غرام / مول، و M (O) = 32 غرام / مول.
ثم، مقدار المادة من هذه العناصر يساوي:
n (كا) = m (كا) / M (كا)؛
n (كا) = 10/40 = 0.25 مول
n (N) = 7/14 = 0، 5 مول
n (O) = 24/16 = 1.5 مول
دعونا نجد نسبة المولي:
n (كا): n (N): n (O) = 0.25: 0.5: 1.5 = 1: 2: 6،
أي أبسط صيغة للجمع بين الكالسيوم والنيتروجين والأكسجين هو كان2O6 وكتلة مولية من 164 غرام / مول [M (كان2O6) = أر (كا) + 2 × أر (N) + 6 × أر (O) = 40 + 2 × 14 + 6 × 16 = 40 + 28 + 96 = 164 g / مول]
للعثور على الصيغة الحقيقية للمركب العضوي، نجد نسبة الكتلة المولية التي تم الحصول عليها:
وبالتالي الصيغة للجمع بين الكالسيوم والنيتروجين والأكسجين لديه شكل كان2O6أو الكالسيوم (نو3)2. هذا هو نترات الكالسيوم.
نسخ المواد من الموقع لا يمكن إلا بإذن
وإدارة البوابة، وإذا كان هناك ارتباط نشط بالمصدر.
سلاكد والجير، واستخدامه.
الجير المطفأ (الصيغة – كا (أوه) 2) هو قاعدة قوية. يمكن أن يحدث في كثير من الأحيان في بعض المصادر تسمى هيدروكسيد الكالسيوم أو "pussies9quot؛.
الميزات: ويمثلها مسحوق أبيض، وهو قابل للذوبان في الماء قليلا. كلما كانت درجة حرارة الوسط أقل، كلما كان قابلية الذوبان أقل. منتجات تفاعلها مع حمض هي أملاح الكالسيوم المقابلة. على سبيل المثال، عندما يتم تخفيض الجير المطفأ إلى حمض الكبريتيك، يتم الحصول على كبريتات الكالسيوم والماء. إذا تركت الحل "pushonki9quot. على الهواء، وسوف تتفاعل مع واحدة من مكونات هذا الأخير – ثاني أكسيد الكربون. مع هذه العملية، يصبح الحل غائما. ويتم تمثيل منتجات هذا التفاعل بواسطة كربونات الكالسيوم والماء. إذا استمر اختراق ثاني أكسيد الكربون، فإن رد فعل يؤدي إلى تشكيل بيكربونات الكالسيوم، الذي ينهار مع ارتفاع درجة حرارة الحل. سوف يتفاعل الجير المطفأ وأول أكسيد الكربون في حوالي 400 درجة مئوية، وسوف تكون منتجاته بالفعل كربونات معروفة وهيدروجين. يمكن للمادة التفاعل مع الأملاح، ولكن فقط إذا كانت العملية تنتهي في هطول الأمطار، على سبيل المثال، إذا كان مختلطة "pushonku9quot. مع كبريتات الصوديوم، وسوف تكون منتجات التفاعل هيدروكسيد الصوديوم وكبريتات الكالسيوم.
ما يجعل الجير: الاسم نفسه "gashenaya9quot. يقول بالفعل أن شيئا قد تم اخماده للحصول على هذه المادة. كما يعلم الجميع، أي مركب كيميائي (وبشكل عام أي شيء) عادة مروي بالماء. ولديها شيء للرد عليه. في الكيمياء، وهناك مادة تسمى "الجير". لذلك، إضافة الماء إليها، والحصول على الاتصال المطلوب.
التطبيق: يستخدم الجير سلاكد لتبييض أي غرفة. كما أنه يخفف من الماء: إذا قمت بإضافة "pushonku9quot. إلى بيكربونات الكالسيوم، ثم أكسيد الهيدروجين و راسب غير قابل للذوبان – يتم تشكيل كربونات المعادن المقابلة. ويستخدم الجير المطفأ في دباغة الجلود، وتهدئة كربونات الصوديوم والبوتاسيوم، وإعداد مركبات الكالسيوم، والأحماض العضوية المختلفة والعديد من المواد الأخرى.
استخدام الحل "pushonki9quot. – المياه الجيرية سيئة السمعة – يمكنك الكشف عن وجود ثاني أكسيد الكربون: عند التفاعل معها، يصبح عكر (الصورة). طب الأسنان لا يمكن الاستغناء عن هيدروكسيد الكالسيوم مناقشة حاليا، وذلك بفضل له في هذا المجال من الطب يمكن تطهير القنوات الجذرية. أيضا باستخدام الجير سلاكد، وجعل هاون الجير، وخلطه مع الرمال. تم استخدام هذا الخليط في العصور القديمة، ثم دون ذلك لا البناء البناء يمكن أن تفعل دون. ومع ذلك، الآن بسبب إطلاق لا لزوم لها من الماء خلال التفاعل "pushonki9quot. مع الرمل، يتم استبدال هذا الحل بنجاح مع الاسمنت. هيدروكسيد الكالسيوم تنتج الأسمدة الجيرية، بل هو أيضا المضافات الغذائية E526 … والعديد من الصناعات الأخرى لا يمكن الاستغناء عنه.
كيكليم، دبق غراء – يتم الحصول على الجير الجير (أكسيد الكالسيوم الخام) عن طريق تكليس الحجر الجيري الذي يحتوي على القليل جدا من الطين أو لا يحتوي على الإطلاق. فهو يجمع بسرعة كبيرة مع الماء، والإفراج عن قدر كبير من الحرارة وتشكيل الجير المطفأ (هيدروكسيد الكالسيوم).
الجير الجير له العديد من الخصائص المفيدة، ويرجع ذلك إلى أنه يجد تطبيق واسع في البناء والصناعة الزراعية.
الميزات: قطع من غرامة مسامية من تساو مع حجم 5 … 10 سم، التي تم الحصول عليها بعد تحميص المواد الخام، ومتوسط الكثافة 1600 … 1700 كجم / م 3.
اعتمادا على محتوى أكسيد المغنيسيوم، وينقسم الجير الهواء إلى الكالسيوم (70 … 90٪ تساو وحتى 5٪ مو)، المغنيسيا (تصل إلى 20٪ مغو) والمغنيسيا عالية أو الدولوميت (مغو 20-40٪).
وينتج الجير الهوائي غير المنتهي ثلاثة أصناف. اعتمادا على الوقت slaking جميع الدرجات المتميزة: الجير المطفأ (slaking الساعة 8 دقائق)؛ متوسطة– إطفاء (تصل إلى 25 دقيقة)، إطفاء ببطء (أكثر من 25 دقيقة).
وينقسم الجير الهواء البناء إلى ثلاثة أصناف.
كثافة الجير تتقلب بين 3.1-3.3 ز / سم 3 ويعتمد بشكل رئيسي على درجة حرارة اطلاق النار، وجود الشوائب، حروق وتحرق.
تعتمد كثافة الجير المائي على درجة تبلورها وهي تساوي الكالسيوم (أوه) 2، وتبلور في شكل لوحات سداسية، 2.23، غير متبلور – 2.08 جم / سم 3.
الكتلة السائبة من الجير الجير في
فإن القطعة تعتمد إلى حد كبير على درجة حرارة اإلطالق وتزيد من 1.6 جم / سم 3) الجير المحترق عند 800 درجة مئوية (إلى 2.9 جم / سم 3) إطالق نار طويل عند 1300 درجة مئوية (.
الكتلة الحجرية لأنواع أخرى من الجير هي كما يلي: الجير الأرض في حالة خفف 900-1100، في ضغط 1100-1300 كجم / م 3. للجير المطفأ (بوشينكا) في حالة تخفيف – 400-500، في ضغط 600-700 كجم / م 3. لاختبار الجير-1300-1400 كجم / م 3.
اللدونة، والذي يحدد قدرة الموثق لإعطاء هاون والخرسانة قابلية جيدة، هو أهم خاصية الجير. ويرتبط اللدونة من الجير مع ارتفاع القدرة على الاحتفاظ بالمياه. الجسيمات الدقيقة من هيدرات هيدروكسيد الكالسيوم، احتفاظا على سطحها بكمية كبيرة من الماء، يخلق نوعا من التشحيم لحبيبات الركام في المونة أو خليط الخرسانة، مما يقلل من الاحتكاك بينهما. وبسبب هذا، حلول الجير لديها قابلية عالية، يتم توزيعها بسهولة وبشكل متساو من قبل طبقة رقيقة على سطح الطوب أو الخرسانة، تلتزم بشكل جيد لهم، هي المياه ريتنتيف، حتى عندما تطبق على الطوب وغيرها من ركائز مسامية.
التطبيق: وتستخدم هذه المادة على نطاق واسع في مختلف مجالات النشاط البشري. وتشمل أكبر المستهلكين: المعادن الحديدية، والزراعة، والسكر، والصناعات الكيماوية، ولب الورق والورق. كما أنها تستخدم في صناعة البناء والتشييد. ومما له أهمية خاصة الاتصال في مجال البيئة. يستخدم الجير لإزالة غاز المداخن من أكسيد الكبريت. كما أن المركب قادر على تهدئة المياه ويعجل المنتجات العضوية والمواد الموجودة فيه. وبالإضافة إلى ذلك، فإن استخدام الجير يوفر تحييد المياه الحمضية الطبيعية ومياه الصرف الصحي. في الزراعة، في اتصال مع التربة، والمركب يزيل الحموضة، التي تضر النباتات المزروعة. الجير الجير يثري التربة مع الكالسيوم. ونتيجة لهذا، فإن ماشينابيليتي من الأرض يزيد، وتدوير الدبال تسارع. وفي الوقت نفسه، يتم تقليل الحاجة إلى إدخال الأسمدة النيتروجينية في جرعات كبيرة.
يستخدم خليط الهيدرات في الدواجن والماشية للتغذية. هذا يلغي نقص الكالسيوم في النظام الغذائي. وبالإضافة إلى ذلك، يستخدم المجمع لتحسين الظروف الصحية العامة عند صيانة وتربية الماشية. وفي الصناعة الكيميائية، تستخدم الجير المطفأ والمواد الماصة لإنتاج الفلورايد وهيدروكلوريد الكالسيوم. في صناعة البتروكيماويات، مركب يحييد القطران الحمضية، وأيضا بمثابة كاشف في التوليف غير العضوية والعضوية الأساسية. ويستخدم على نطاق واسع الجير في البناء. ويرجع ذلك إلى ملاءمة البيئة العالية للمادة. يتم استخدام الخليط في إعداد المجلدات والخرسانات وقذائف الهاون، وتصنيع منتجات البناء.
تآكل المعادن وطرق الوقاية من التآكل
في ظل الظروف العادية، يمكن للمعادن الدخول في تفاعلات كيميائية مع المواد الموجودة في البيئة والأكسجين والماء. على سطح المعادن تظهر البقع، يصبح المعدن هشة ولا تحمل الأحمال. وهذا يؤدي إلى تدمير المنتجات المعدنية، التي أنفقت منها الكثير من المواد الخام والطاقة وكمية الجهد البشري.
تآكل المعادن – عملية تدمير المعادن والسبائك بسبب التفاعل الكيميائي أو الكهروكيميائي مع البيئة الخارجية، ونتيجة لذلك تتأكسد المعادن وتفقد خصائصها المتأصلة. التآكل – العدو من المنتجات المعدنية. سنويا في العالم نتيجة للتآكل، 10 … 15٪ من المعدن المصهر، أو 1 … 1،5٪ من جميع المعادن المتراكمة واستغلالها من قبل الإنسان، فقدت.
التآكل الكيميائي – تدمير المعادن والسبائك نتيجة للأكسدة عند التفاعل مع الغازات الجافة في درجات حرارة عالية أو مع سوائل عضوية – منتجات زيتية، كحول، إلخ.
التآكل الكهروكيميائية – تدمير المعادن والسبائك في المياه والمحاليل المائية. لتطوير التآكل، يكفي أن المعدن هو ببساطة مغطاة طبقة رقيقة جدا من الماء كثف (سطح الرطب). ونظرا لعدم تجانس هيكل المعدن أثناء التآكل الكهروكيميائي، يتم تشكيل أزواج الجلفاني (الأنود الكاثود) فيه، على سبيل المثال بين حبيبات (بلورات) من المعدن، والتي تختلف عن بعضها البعض كيميائيا. ذرات المعدن من الأنود تمر في الحل في شكل الكاتيونات. هذه الكاتيونات، جنبا إلى جنب مع الأنيونات الواردة في الحل، تشكل طبقة من الصدأ على سطح المعدن. وتدمر المعادن أساسا بالتآكل الكهروكيميائي.
تآكل المعادن يسبب أضرار اقتصادية كبيرة، بسبب التآكل، المعدات، الآلات، تفشل الآلات، يتم تدمير الهياكل المعدنية. وهي عرضة بشكل خاص لتآكل المعدات التي تتلامس مع بيئة عدوانية، على سبيل المثال، حلول الأحماض والأملاح.
في ظل الظروف العادية، يمكن للمعادن الدخول في تفاعلات كيميائية مع المواد الموجودة في البيئة والأكسجين والماء. على سطح المعادن تظهر البقع، يصبح المعدن هشة ولا تحمل الأحمال. وهذا يؤدي إلى تدمير المنتجات المعدنية، التي أنفقت منها الكثير من المواد الخام والطاقة وكمية الجهد البشري.
التآكل هو التدمير التلقائي للمعادن والسبائك تحت تأثير البيئة.
وهناك مثال حي على التآكل هو الصدأ على سطح الصلب ومنتجات الحديد الزهر. سنويا، بسبب التآكل، يتم فقدان حوالي ربع الحديد في العالم. تكاليف إصلاح أو استبدال السفن والسيارات والأجهزة والاتصالات، وأنابيب المياه هي أعلى بكثير من تكلفة المعدن الذي يتم تصنيعها. منتجات التآكل تلوث البيئة وتؤثر سلبا على حياة وصحة الناس.
يحدث التآكل الكيميائي في مختلف الصناعات الكيميائية. في جو من الغازات التفاعلية (الهيدروجين، كبريتيد الهيدروجين والكلور) في المتوسط من الأحماض والقلويات والأملاح، وكذلك الأملاح المنصهرة، وغيرها من المواد ردود فعل معينة تحدث تنطوي على المواد المعدنية التي تصنع وحدات، التي تتم فيها عملية كيميائية. يحدث تآكل الغاز عند درجات حرارة مرتفعة. تحت تأثيره تقع التجهيزات من الأفران، وأجزاء من محركات الاحتراق الداخلي. يحدث التآكل الكهروكيميائي إذا كان المعدن موجود في أي محلول مائي.
المكونات الأكثر نشاطا في البيئة التي تعمل على المعادن، والأكسجين O2، H2O، وبخار الماء والكربون (IV) أكسيد الكربون CO2، الكبريت (IV) أكسيد، SO2، N (IV) NO2 أكسيد. يتم تسريع عملية التآكل إلى حد كبير عن طريق الاتصال من المعادن مع المياه المالحة. لهذا السبب، تصدأ السفن في مياه البحر أسرع من المياه العذبة.
جوهر التآكل هو أكسدة المعادن. منتجات التآكل يمكن أن تكون أكاسيد، هيدروكسيدات، أملاح، الخ. على سبيل المثال، يمكن وصف تآكل الحديد بشكل تخطيطي بالمعادلة التالية:
4Fe + 6H2O + 3O2 → 4Fe (أوه) 3.
فمن المستحيل لوقف التآكل، ولكن يمكن تباطأ. هناك العديد من الطرق لحماية المعادن من التآكل، ولكن الطريقة الرئيسية هي لمنع الاتصال من الحديد مع الهواء. لهذا، يتم طلاء المنتجات المعدنية، ملمع أو المغلفة بطبقة من مواد التشحيم. في معظم الحالات، وهذا يكفي لمنع المعدن من التدهور لعدة عشرات أو حتى مئات السنين. طريقة أخرى لحماية المعادن من التآكل هو طلاء الكهروكيميائية من سطح المعدن أو سبيكة مع المعادن الأخرى التي هي مقاومة للتآكل (طلاء النيكل، والكروم الطلاء، الجلفنة والفضة والتذهيب). وغالبا ما تستخدم سبائك مقاومة للتآكل الخاصة في الهندسة. لإبطاء تآكل المنتجات المعدنية في البيئة الحمضية، وتستخدم مواد خاصة – مثبطات أيضا.
حياة ونشاط آم بتليروف
ولد الكسندر بتليروف في عام 1828 في بتليروفكا، وهي قرية صغيرة ليست بعيدة عن كازان، حيث تقع ملكية والده. لم تتذكر ساشا والدتها، توفيت بعد 11 يوما من ولادته. نشأت من قبل والده، وهو رجل متعلم، ساشا أراد أن يكون مثله في كل شيء.
أولا ذهب إلى مدرسة داخلية، ثم دخل أول قازان صالة للألعاب الرياضية، والمعلمين والتي كانت من ذوي الخبرة جدا، المدربين تدريبا جيدا، كانوا يعرفون كيفية اهتمام الطلاب. ساشا تعلم بسهولة المواد، منذ من طفولته في وقت مبكر كان معتادا على العمل المنهجي. اجتذبت له العلوم الطبيعية خاصة.
بعد نهاية صالة الألعاب الرياضية، خلافا لرغبة والده، دخل ساشا قسم العلوم الطبيعية في جامعة كازان، على الرغم من أنه حتى الآن فقط كمستمع، لأنه كان لا يزال قاصرا. فقط في العام التالي، 1845، عندما كان الشاب يبلغ من العمر 17 عاما، وظهر اسمه في القائمة المقبولة للسنة الأولى.
في عام 1846، أصيب الإسكندر بالمرض مع التيفوس و نجا بأعجوبة، ولكن والده، المصاب منه، مات. في الخريف، جنبا إلى جنب مع خالتي، انتقلوا إلى كازان. تدريجيا، أخذ الشباب الخاصة بهم، والصحة والمرح عاد إلى ساشا. كان الشباب بتليروف مع بذل العناية الاستثنائية، ولكن، لمفاجأة له، لاحظ أن أعظم السرور كان في إعطاء له محاضرات في الكيمياء. محاضرات البروفيسور كلاوس لم يرضيه، وبدأ بانتظام لحضور محاضرات نيكولاي نيكولايفيتش زينين، التي تم قراءتها لطلبة قسم الفيزياء والرياضيات. قريبا جدا زينين، ومراقبة ألكسندر خلال العمل المختبري، لاحظت أن هذا الطالب شقراء الموهوبين بشكل غير عادي ويمكن أن تصبح باحثا جيدا.
عمل بوتليروف بنجاح، ولكن أكثر وأكثر في كثير من الأحيان فكر حول مستقبله، لا يعرفون ما لاختيار في النهاية. هل تريد أن تفعل علم الأحياء؟ ولكن، من ناحية أخرى، أليس غياب فكرة واضحة عن ردود الفعل العضوية توفر إمكانيات لا نهاية لها للبحث؟
للحصول على درجة من المرشح، كان بتليروف لتقديم أطروحة في نهاية الجامعة. وبحلول ذلك الوقت، غادر زينين كازان بطرسبرغ ولم يكن لديه خيار سوى دراسة العلوم الطبيعية. بالنسبة لعمل المرشح أعد بتليروف مقالا بعنوان “فراشات اليوم للحيوانات الفولغا أورال”. ومع ذلك، فإن الظروف المتقدمة بحيث ألكسندر لا يزال لديه للعودة إلى الكيمياء.
وبعد أن وافق المجلس على درجته الأكاديمية، ظل بتليروف في الجامعة. ولم يتمكن الأستاذ الوحيد للكيمياء كلاوس من إجراء جميع الدروس بنفسه وكان يحتاج إلى مساعد. أصبحوا بتليروف. في خريف عام 1850، اجتاز بتليروف الامتحانات للحصول على درجة الماجستير في الكيمياء وبدأ على الفور أطروحة الدكتوراه “على الزيوت الأساسية”، والتي دافع عنها في وقت مبكر من العام المقبل. بالتوازي مع إعداد المحاضرة بتليروف تشارك في دراسة مفصلة لتاريخ العلوم الكيميائية. عمل العالم الشاب بجد سواء في مكتبه أو في المختبر أو في المنزل.
وفقا لعماته، شقة الكرة القديمة غير مريحة، لذلك أزالوا آخر، أكثر اتساعا من صوفيا تيموفيفنا أكساكوفا، وهي امرأة كانت نشطة وعزم. أخذت بتليروفا مع رعاية الأمومة، ورأيت فيه طرفا مناسبا لابنتها. على الرغم من العمل المستمر في الجامعة، ألكسندر ميخائيلوفيتش بقي شخص مرح ومجتمعي. كان بعيدا عن تمييز “سيئة الغياب الأستاذية” سيئة السمعة، وابتسامة ودية وسهولة في التداول جعلته ضيفا ترحيبا في كل مكان. وأشارت صوفيا تيموفيفنا مع الارتياح إلى أن العالم الشاب لم يكن غير مبال بنادينكا. كانت الفتاة جيدة حقا: جبين ذكي عالية، عيون ساطعة كبيرة، ملامح منتظمة صارمة وبعض سحر خاص. أصبح الشباب أصدقاء حميمين، وبدأت في نهاية المطاف إلى الشعور بالحاجة إلى أن تكون معا في كثير من الأحيان، وتقاسم الأفكار الأكثر حميمية. قريبا نادزدا ميخايلوفنا غوميلينا – ابنة الكاتب S.T. أصبح أكساكوفا زوجة الكسندر ميخائيلوفيتش.
كان معروفا بتليروف ليس فقط باعتباره الكيميائي المتميز، ولكن أيضا كما النباتي الموهوبين. أجرى تجارب مختلفة في بيوته الزراعية في كازان وبتليروفكا، كتب مقالات عن مشاكل البستنة وزراعة الأزهار والزراعة. مع الصبر النادر والحب، لاحظ تطور الكاميليا لطيف، الورود الخصبة، وأخرج أصناف جديدة من الزهور.
4 يونيو 1854 تلقى بتلروف تأكيدا لجائزة الدكتوراه في الكيمياء والفيزياء. الأحداث تكشفت مع سرعة لا تصدق. مباشرة بعد حصوله على درجة الدكتوراه، تم تعيين بتليروف أستاذا في الكيمياء الكيمياء في جامعة كازان. في أوائل عام 1857، أصبح أستاذا، وفي صيف ذلك العام حصل على إذن لرحلة عمل أجنبية.
وصل بوتلروف الى برلين فى نهاية الصيف. ثم واصل رحلته إلى ألمانيا وسويسرا وإيطاليا وفرنسا. وكان الهدف النهائي من رحلته باريس، المركز العالمي للعلوم الكيميائية في ذلك الوقت. وقد استقطب، قبل كل شيء، من خلال لقاء مع أدولف ورز. عمل بتليروف في مختبر ورز لمدة شهرين. كان هنا أنه بدأ دراساته التجريبية، والتي توجت على مدى السنوات العشرين المقبلة مع اكتشاف العشرات من المواد الجديدة وردود الفعل. توليفات المثالية العديد من Butlerova الإيثانول والاثيلين والكحول العالي، بلمرة الهيدروكربونات اثيلين تكمن في أصل عدد من الصناعات، وبالتالي كان لها تأثير تحفيز مباشر.
أثناء دراسة الهيدروكربونات، أدرك بتليروف أنها تمثل فئة خاصة جدا من المواد الكيميائية. تحليل هيكلها وخصائصها، لاحظ العالم أن هناك نمط صارم. كما شكلت أساس نظريته للبنية الكيميائية.
وقد أثار تقريره في أكاديمية باريس للعلوم اهتماما عالميا ومناقشة حية. وقال بوتليروف: “ربما حان الوقت لأن تصبح تحقيقاتنا أساسا لنظرية جديدة للهيكل الكيميائي للمواد. هذه النظرية سوف تختلف في دقة القوانين الرياضية، وسوف تسمح لنا أن نتوقع خصائص المركبات العضوية. ” ولم يعرب أحد عن مثل هذه الأفكار.
بعد بضع سنوات، خلال رحلته الثانية في الخارج، قدم بتليروف للمناقشة النظرية التي أنشأها. وقدم تقريرا في المؤتمر ال 36 للعلماء والأطباء الطبيعيين الألمان في سباير. عقد المؤتمر في سبتمبر 1861goda.
وقدم عرضا إلى القسم الكيميائي. وكان الموضوع أكثر من مجرد اسم متواضع: “شيء عن التركيب الكيميائي للهيئات”.
وتحدث بتليروف ببساطة وبوضوح. دون الدخول في تفاصيل لا داعي لها، وقدم الجمهور إلى نظرية جديدة من التركيب الكيميائي للمواد العضوية: أثار تقريره مصلحة لم يسبق لها مثيل.
التقى مصطلح “التركيب الكيميائي” قبل Butlerov، لكنه تفسيرها واستخدامها لتحديد مفهوم جديد للترتيب السندات الذرية في الجزيئات. نظرية التركيب الكيميائي هو الآن الأساس للجميع، دون استثناء، أقسام حديثة من الكيمياء الاصطناعية.
لذلك، أعلنت النظرية حقها في الوجود. وطالب بمزيد من التطوير، وحيث، إن لم يكن في كازان، ينبغي أن تفعل ذلك، لأنه ولدت نظرية جديدة، وعملت هناك خالقها. وبالنسبة إلى بتليروف، تبين أن واجبات رئيس الجامعة عبء ثقيل لا يطاق. وطلب عدة مرات الإفراج عنه من هذا المنصب، ولكن جميع طلباته ظلت غير راضية. لم يتركه كاريز في المنزل. فقط في الحديقة، والقيام الزهور المفضلة له، وقال انه نسي المخاوف والمتاعب في اليوم الماضي. في كثير من الأحيان جنبا إلى جنب معه في الحديقة عملت ابنه ميشا. سأل الكسندر ميخائيلوفيتش الصبي عن الأحداث في المدرسة، وقال تفاصيل غريبة عن الزهور.
كان عام 1863، أسعد سنة في حياة العالم العظيم. كان بتليروف على الطريق الصحيح. نجح لأول مرة في تاريخ الكيمياء للحصول على أبسط الكحول الثالث – الكحول البوتيلي الثالث، أو تريميثيلكاربينول. بعد ذلك بوقت قصير، أفادت الأدب التوليف الناجح للكحول البوتيل الأولي والثانوي.
وقد عرف العلماء الكحول ايزوبيوتيل منذ عام 1852، عندما كان معزولا لأول مرة من الزيوت النباتية الطبيعية. الآن لم يكن هناك أي شك حول أي نزاع، حيث كان هناك أربعة الكحول البوتيل مختلفة، وجميعهم من الأيزومرات.
في 1862 – 1865 سنة اقترح Butlerof التوجيهي نظرية عكسها المماكبة صنوانية، وآلية منها في Butlerova يتألف من الانقسام من الجزيئات من بنية ومخلفات المجمع لتشكيل التركيب الجزيئي مختلفة. كان فكرة رائعة. وأكد العالم العظيم على ضرورة اتباع نهج دينامي في العمليات الكيميائية، أي معالجتها كتوازن.
النجاح جلب الثقة العلماء، ولكن في نفس الوقت تعيين أمامه مهمة جديدة، أكثر صعوبة. كان من الضروري تطبيق نظرية البنيوية لجميع التفاعلات والمركبات الكيمياء العضوية، والأهم، لكتابة كتاب جديد حول الكيمياء العضوية، حيث سيتم النظر في جميع الظواهر من وجهة نظر نظرية جديدة للهيكل.
عمل بتليروف على الكتاب المدرسي لمدة سنتين تقريبا دون انقطاع. وقد نشر كتاب “مقدمة لدراسة كاملة من الكيمياء العضوية” في ثلاث طبعات في 1864 – 1866. لم تذهب في أي مقارنة، ولا مع واحدة من الكتب المدرسية المعروفة آنذاك. وكان هذا العمل من وحي الوحي Butlerova – مجرب الكيميائي والفيلسوف، إعادة بناء كل العلوم المادية المتراكمة على مبدأ جديد، على أساس التركيب الكيميائي.
وقد تسبب الكتاب في ثورة حقيقية في العلوم الكيميائية. بالفعل في عام 1867، بدأ العمل على ترجمتها ونشرها باللغة الألمانية. وبعد ذلك بوقت قصير، نشرت المنشورات بجميع اللغات الأوروبية الرئيسية تقريبا. وفقا للباحث الألماني فيكتور ماير، أصبحت “النجم التوجيهي” في الغالبية العظمى من البحوث في مجال الكيمياء العضوية.
منذ الانتهاء من الكسندر ميخائيلوفيتش العمل على الكتاب المدرسي، وقال انه قضى على نحو متزايد الوقت بتليروفكا. وحتى خلال العام الدراسي، سافرت الأسرة عدة مرات في الأسبوع إلى القرية. شعر بتليروف هنا نفسه بعيدا عن المخاوف وكرس نفسه تماما لهواياته المفضلة: الزهور ومجموعات من الحشرات.
الآن عمل بوتليروف أقل في المختبر، لكنه تابع عن كثب الاكتشافات الجديدة. في ربيع عام 1868 بمبادرة من الصيدلي الشهير مندليف، دعي الكسندر ميخائيلوفيتش لجامعة سانت بطرسبرغ، حيث بدأ في إلقاء محاضرات وأتيحت له الفرصة لتنظيم المختبر الكيميائي الخاصة بهم. طور بتليروف منهجية جديدة لتدريس الطلاب، واقترح الآن الممارسة المختبرية المقبولة عالميا، والتي تم تدريب الطلاب على العمل مع مجموعة متنوعة من المعدات الكيميائية.
في الوقت نفسه مع النشاط العلمي، بوتليروف ينضم بنشاط الحياة العامة في سانت بطرسبرغ. وفي ذلك الوقت، كان الجمهور التقدمي مهتما بشكل خاص بتعليم المرأة. وينبغي أن يكون للمرأة حرية الوصول إلى التعليم العالي! ونظمت دورات المرأة العليا في الأكاديمية الطبية الجراحية، وبدأت الفصول الدراسية في دورات بيستوزيف النسائية، حيث قدم بتليروف محاضرات في الكيمياء.
وقد اعترفت أكاديمية العلوم بنشاط بوتليروف العلمي المتعدد الجوانب. في عام 1871 تم انتخابه أكاديمي غير عادي، وبعد ثلاث سنوات – وهو أكاديمي عادي، الذي أعطى له الحق في الحصول على شقة في مبنى الأكاديمية. عاش هناك ونيكولاي نيكوليفيتش زينين. وعزز الحي القريب الصداقة الطويلة الأمد.
مرت السنوات لا محالة. أصبح العمل مع الطلاب صعبا للغاية بالنسبة له، وقرر بتليروف ترك الجامعة. وقدم محاضرة وداع في 4 أبريل 1880، قبل طلاب السنة الثانية. وقد اجتمعوا برسالة رحيل الأستاذ الحبيب بأسف عميق. قرر المجلس الأكاديمي أن يطلب من بتليروف البقاء وانتخابه لمدة خمس سنوات أخرى.
قرر العالم الحد من نشاطه في الجامعة فقط من خلال قراءة المسار الرئيسي. ومع ذلك، عدة مرات في الأسبوع ظهر في المختبر وأشرف على العمل.
طوال حياته بوتليروف حملت شغف واحد – تربية النحل. في تركة له نظمت المنحل المثالي، وفي السنوات الأخيرة من الحياة مدرسة حقيقية للفلاحين الفلاحين. وتفاخر بتليروف بفخر كتابه “النحل، حياته وقواعد النحل الذكي” أكثر من مجرد الأعمال العلمية.
اعتقد بتليروف أن عالما حقيقيا يجب أن يكون أيضا شعبيا من علمه. وبالتوازي مع المقالات العلمية، قام بإنتاج كتيبات متاحة للجمهور، تحدث فيها بألوان زاهية وملونة عن اكتشافاته. آخرهم أنهى قبل ستة أشهر من وفاته.
توفي العالم من عرقلة الأوعية الدموية في 5 أغسطس 1886.
